Топическая терапия при острых тонзиллофарингитах. Лечение тонзиллофарингита
- Топическая терапия при острых тонзиллофарингитах. Лечение тонзиллофарингита
- Neisseria spp.(условно-патогенные м/о) 10^6. Что означают отклонения в мазке из влагалища
- Str. гр. viridans 10*4 neisseria spp. 10*4. Стрептококк группы вириданс (streptococcus viridans): что это за бактерия?
- Neisseria spp антибиотики. Этиологические факторы НГУ
- Neisseria spp норма. Neisseria (нейссерии)
- Neisseria spp 10*2. Н — Нейссерии
- Neisseria spp не патогенна. Что такое баквагиноз
- Neisseria spp лечение. Клиническая эффективность
Топическая терапия при острых тонзиллофарингитах. Лечение тонзиллофарингита
Консервативная терапия
Инфекции горла, как правило, не требуют госпитализации, за исключением случаев тяжелой интоксикации и высокого риска осложнений. Больным с тонзиллофарингитом рекомендуется обильное теплое витаминизированное питье, голосовой покой, отказ от грубой, острой, слишком горячей пищи. Назначается системное и местное лечение, включающее:
- Этиотропную терапию. При ОРВИ применяются интерфероны и индукторы интерферона. Тонзоллофарингиты, вызванные БГСА, требуют проведения антибактериальной терапии с использованием β-лактамов, цефалоспоринов, макролидов. При фарингомикозах показана антимикотическая терапия.
- Вспомогательную терапию. Для облегчения лихорадочного состояния и болей в горле рекомендуется прием НПВС. На фоне проводимой системной терапии целесообразно назначение антигистаминных препаратов. При затянувшемся или рецидивирующем тонзиллофарингите возможен прием адаптогенов, витаминов.
- Местные процедуры. Включают полоскание горла фиторастворами, использование оросептиков в виде спреев, пастилок для рассасывания. Рекомендуется прием топических иммуномодуляторов. По показаниям осуществляется промывание миндалин (ручное, на аппарате Тонзиллор ).
- Физиотерапия. При отсутствии температуры проводятся лекарственные ингаляции , ОКУФ-терапия , ультрафонофорез на область миндалин. Доказанным саногенным и противовоспалительным эффектом обладает галотерапия .
Хирургическое лечение
К хирургической тактике прибегают при развитии гнойных осложнений. При формировании паратонзиллярного абсцесса производят его широкое рассечение или абсцесстонзиллэктомия . При рецидиврующих тонзиллофарингитах выполняется плановая тонзиллэктомия .
Neisseria spp.(условно-патогенные м/о) 10^6. Что означают отклонения в мазке из влагалища
Отклонения от нормы в мазке из влагалища говорят о следующем:
Низкое содержание палочек Дедерлейна указывает на плохой микробиоценоз с преобладанием болезнетворной микрофлоры. Палочки Дедерлейна — это вытянутые по форме лактобактерии, которые в качестве продукта жизнедеятельности образуют молочную кислоту. Благодаря им поддерживается кислая среда во влагалище, защищающая от проникновения патогенных микроорганизмов. Молочная кислота активизирует иммунные клетки, ведущие борьбу с микробами.
При снижении числа палочек Дедерлейна у женщины развивается влагалищный дисбактериоз. Это случается во время болезни, гормональной терапии, приёме антибиотиков и гормонов, сильном или затяжном стрессе, заражении ЗППП.
При обнаружении малого количества лактобактерий женщине дополнительно назначают ПАП-тест на скрытые инфекции. Если он не даст положительного ответа, то пациентки прописывают вагинальные свечи, которые подавляют патогенную микрофлору, помогая палочкам Дедерлейна.
Высокое содержание кокковой флоры и снижение палочковый флоры указывает на ослабление иммунитета или активизацию условно-патогенной микрофлоры. Степень чистоты влагалища определяется от нормоциноза до вагинита.
- При 1 степени (нормоценоз) кислотность влагалища составляет рН 3,8 ̶ 4,2, много палочек Дедерлейна, нет лейкоцитов, имеются единичные клетки эпителия.
- При 2 степени чистоты количество лейкоцитов увеличивается до 10, а клеток эпителия имеется довольно много. Кислотность увеличивается до рН 4,0 ̶ 4,5.
- При 3 степени чистоты кислотная среда сменяется слабощелочной (рН 5,0 ̶ 5,5), кокковая микрофлора доминирует над лактобактериями, лейкоциты в пределах норма. 4 степень чистоты лактобактерий нет вообще, среда во влагалище щелочная (рН 6,0 ̶ 6,5). Помимо различных кокков, встречаются единичные трихомонады и ключевые клетки.
Нормальный мазок соответствует 1 и 2-й степеням чистоты. В этом случае «население» слизистой поверхности влагалища должно соответствовать параметрам:
- лактобактерии в количестве 10 7 — 10 9 КОЕ/мл (КОЕ — это одна микробная клетка (колониеобразующая единица), которая в питательной среде активно размножается и образует колонию);
- стрептококки до 10 5 КОЕ/МЛ;
- кандида, клостридии, стафилококки, превотеллы — до 10 4 КОЕ/мл;
- уреаплазма, микоплазма — до 10 3 КОЕ/мл;
При 3 степени чистоты у женщины диагностируется бактериальный вагиноз — нарушение естественного баланса при снижении количества лактобактерий и увеличении содержания грамотрицательных палочек.
Также при 3 и 4 степени чистоты влагалища характерен вагинит (кольпит) — увеличение количества условно-патогенной микрофлоры, сопровождающееся воспалением поверхности влагалища.
Str. гр. viridans 10*4 neisseria spp. 10*4. Стрептококк группы вириданс (streptococcus viridans): что это за бактерия?
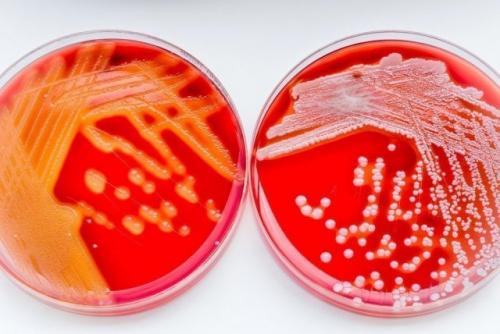
Стрептококки – это большая группа бактерий, некоторые из которых в норме присутствуют в организме человека, а другие – вызывают серьезные заболевания. Один из представителей стрептококковой флоры – это Streptococcus viridans. В данной статье мы рассмотрим характеристики стрептококка группы вириданс, поговорим о том, насколько он опасен.
Стрептококк вириданс: что это за бактерия?
Streptococcus viridans – это грамположительная бактерия, имеющая шаровидную или овоидную форму, в норме присутствующая в организме человека. Если быть точнее, то под данным названием понимается группа малопатогенных стрептококков, в норме в небольшом количестве обитающих на слизистой оболочке дыхательной, пищеварительной и мочеполовой системы.
В обычных условиях количествона слизистых оболочках внутренних органов не должно быть более 30% от всего числа микроорганизмов, заселяющих эту область. В этом случае стрептококковая флора не несет никакой угрозы, не становится причиной каких-либо болезней.
Однако иногда может возникать такая ситуация, при которой количество стрептококков возрастает. Как правило, это наблюдается при значительном снижении уровня иммунной защиты. Так, например, S. viridans нередко обнаруживается у ВИЧ-инфицированных пациентов. В 2019 году ученые из Омского государственного медицинского университета опубликовали работу, в которой было установлено, что S. viridans является частой находкой при культуральном исследовании мокроты у ВИЧ-инфицированных пациентов с различными инфекционными заболеваниями легочной ткани.
Таким образом, чрезмерно активное размножение стрептококковой флоры приводит к развитию местного воспаления в той или иной анатомической области. С течением времени бактерии могут прорываться в, приводя к развитию тяжелых заболеваний.
Какие заболевания вызывает стрептококк вириданс?

Стрептококк группы вириданс может провоцировать возникновение самых различных болезней.
Чрезмерное размножение стрептококковой флоры в ротовой полости может стать причиной кариеса, пародонтита. Кроме этого, увеличение количества стрептококков нередко приводит к воспалительному поражению глотки, легких, почек. Уретрит, цервицит также достаточно часто развиваются под воздействием S. viridans.
К другим возможным заболеваниям относятся:
- Эндокардит;
- Воспаление кожи и мягких тканей;
- Лимфаденит;
- Сепсис и многое другое.
Как его обнаружить?
Обнаружение стрептококковой флоры в человеческом организме, как правило, не представляет каких-либо сложностей.
Классическим методом диагностики является бактериологическое исследование. В качестве материала для бактериологического исследования могут использоваться мазки из носовой полости и глотки, соскоб с пораженного участка кожных покровов, моча,и прочее. В нормальных условиях по результатам бактериологии количество S. viridans не должно быть более 10 в 4 степени. Если обнаруживается больше бактерий, можно говорить о том, что именно они спровоцировали заболевание.
Также при необходимости может проводиться ПЦР-диагностика.
Neisseria spp антибиотики. Этиологические факторы НГУ
Негонококковые уретриты у мужчин могут быть вызваны самыми разнообразными возбудителями, включая облигатные патогены, такие как Chlamydia (C.) trachomatis или Mycoplasma (M.) genitalium, и условно-патогенные микроорганизмы, например другие микоплазмы, в частности Ureaplasma (U.) urealyticum. Причиной НГУ могут быть также вирусы и простейшие.
Роль хламидий в возникновении НГУ. В 70–80-е гг. прошлого века считалось, что около 50% и более случаев НГУ вызваны хламидийной инфекцией. Исследования последующих десятилетий продемонстрировали существенное снижение частоты уретритов у мужчин, вызванных C. trachomatis, — до 20% и менее (M. Shahmanesh, 2001; М. А. Гомберг и соавт., 2002; C. S. Bradshaw и соавт., 2006). В то же время в течение последних лет в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем (ИППП). В нашей стране, начиная с 2004 г., это вторая по распространенности регистрируемая ИППП после трихомониаза.
Уретриты, вызванные С. trachomatis, проявляются обычно скудной клинической симптоматикой, но могут сопровождаться, хотя это нетипично, и признаками острого воспаления, сходными с теми, которые характерны для гонореи.
Роль генитальных микоплазм в возникновении НГУ. Установлено, что человек является естественным хозяином 13 видов микоплазм, из которых возможными возбудителями НГУ могут являться M. hominis, M. genitalium и U. urealyticum. Кроме этих видов микоплазм в урогенитальном тракте также обнаруживают M. fermentans, M. primatum, M. pirum, M. spermatophilum, M. penetrans, M. pneumoniae. Их роль и взаимодействие с организмом человека сегодня активно исследуются, но пока их значение в возникновении уретритов у мужчин не вполне ясно. Так, S. Sharma и соавторы (1998), используя полимеразную цепную реакцию (ПЦР) в дополнение к бактериологическому исследованию, выявили M. pneumoniae у мужчин, которые болели рецидивирующим уретритом и предъявляли жалобы на боль в области уретры и предстательной железы.
Вопрос о роли генитальных микоплазм в этиологии НГУ остается нерешенным из-за широкого распространения этих микроорганизмов и их частого выявления у лиц, не имеющих клинической симптоматики. Мнения исследователей по данному вопросу расходятся. Одни авторы склонны относить микоплазмы к облигатным патогенам, вызывающим уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности и плода. Соответственно, по мнению этих авторов, следует добиваться эрадикации микоплазм в случае их выявления. Другие считают, что микоплазмы являются условно-патогенной флорой урогенитального тракта, и лишь при определенных условиях способны вызывать инфекционно-воспалительные заболевания мочеполовых органов. Большинство зарубежных авторов относят все микоплазмы, за исключением M. genitalium, к условно-патогенной флоре. Именно поэтому в МКБ-10 таких заболеваний, как «микоплазмоз», «уреаплазмоз» или «уреаплазменная инфекция», не зарегистрировано. По мнению многих исследователей, из микоплазм без всяких оговорок к числу патогенов, способных вызывать уретриты, можно отнести только M. genitalium. Однако опыты на экспериментальных моделях, эксперименты по аутоинокуляции культуры U. urealyticum , а также изучение иммунного ответа макроорганизма доказывают участие этих прокариотов в возникновении НГУ. Статистические исследования установили достоверную корреляцию между наличием в мазках из уретры уреаплазмы и хроническими НГУ, в то же время не выявлено достоверной взаимосвязи U. urealyticum c острыми НГУ (P. Horner, 2001). Также не доказана роль U. parvum в возникновении уретритов.
Neisseria spp норма. Neisseria (нейссерии)
Представленная в разделе информация о лекарственных препаратах, методах диагностики и лечения предназначена для медицинских работников и не является инструкцией по применению.
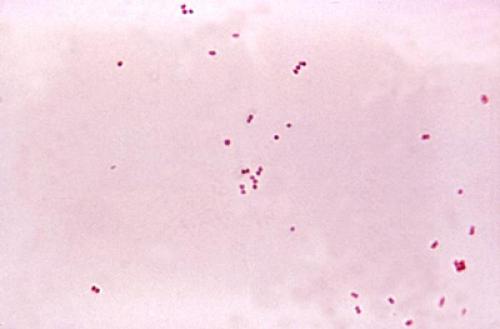 Нейссерии ( Neisseria ) — род грамотрицательных бактерий, включающий в себя как целый ряд видов — комменсалов, обитающих на слизистых оболочках человека, так и возбудителей серьёзных заболеваний, в частности, гонореи () и менингита ( Neisseria meningitidis ). Традиционно Neisseria gonorrhoeae может называться гонококком,— менингококком.Под микроскопом Neisseria имеют вид кофейных зёрен. Neisseria обнаруживается вздоровых людей (при условии отсутствия в нём в доминирующем количестве) (., 2012).Ряд видов нейссерий, в частности N. bacilliformis, N. cinerea, N. elongata, N. flavescens, N. lactamica, N. mucosa, N. perflava, N. polysaccharea, N. sicca, N. subflava , являются непатогенными. Однако эти виды также могут быть ассоциированы с некоторыми заболеваниями. Neisseria lactamica присутствует в носоглотке многих здоровых детей. Антигены безвредных для человека Neisseria lactamica и Neisseria meningitidis одинаковы, поэтому носительство Neisseria lactamica предположительно предохраняет от развития менингита. Neisseria spp. ассоциированы с синдромом дефицита внимания и гиперактивности,,,().
Нейссерии ( Neisseria ) — род грамотрицательных бактерий, включающий в себя как целый ряд видов — комменсалов, обитающих на слизистых оболочках человека, так и возбудителей серьёзных заболеваний, в частности, гонореи () и менингита ( Neisseria meningitidis ). Традиционно Neisseria gonorrhoeae может называться гонококком,— менингококком.Под микроскопом Neisseria имеют вид кофейных зёрен. Neisseria обнаруживается вздоровых людей (при условии отсутствия в нём в доминирующем количестве) (., 2012).Ряд видов нейссерий, в частности N. bacilliformis, N. cinerea, N. elongata, N. flavescens, N. lactamica, N. mucosa, N. perflava, N. polysaccharea, N. sicca, N. subflava , являются непатогенными. Однако эти виды также могут быть ассоциированы с некоторыми заболеваниями. Neisseria lactamica присутствует в носоглотке многих здоровых детей. Антигены безвредных для человека Neisseria lactamica и Neisseria meningitidis одинаковы, поэтому носительство Neisseria lactamica предположительно предохраняет от развития менингита. Neisseria spp. ассоциированы с синдромом дефицита внимания и гиперактивности,,,().
Neisseria в систематике бактерий
Род Neisseria входит в семейство Neisseriaceae , порядок Neisseriales , класс Betaproteobacteria , тип протеобактерии ( Proteobacteria ), царство Бактерии.В род Neisseria в настоящее время включены виды: N. animalis, N. animaloris, N. arctica, N. bacilliformis, N. bergeri, N. canis, N. cinerea, N. dentiae, N. dumasiana, N. elongata, N. europea, N. flava, N. flavescens,, N. iguanae, N. lactamica, N. macacae,, N. mucosa, N. musculi, N. oralis, N. perflava, N. pharyngis, N. polysaccharea, N. shayeganii, N. sicca, N. skkuensis, N. subflava, N. tadorna, N. wadsworthii, N. weaveri, N. zoodegmatis. В составе вида Neisseria elongata выделены подвиды: Neisseria elongata subsp. elongata, Neisseria elongata subsp. glycolytica, Neisseria elongata subsp. nitroreducens . В составе вида Neisseria gonorrhoeae — подвид Neisseria kochii , вида Neisseria pharyngis — подвид Neisseria pharyngis subsp. flava .Антибиотики и вакцины, активные в отношении Neisseria
Следующие антимикробные средства (из описанных в данном справочнике) активны в отношении Neisseria и отдельных видов:- ципрофлоксацин — активен в отношении Neisseria spp.
Neisseria spp 10*2. Н — Нейссерии
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор раздела: Трубачева Елена Сергеевна, врач – клинический фармаколог, более 15 лет занимающаяся практическими вопросами лечения и профилактики внутрибольничных инфекций и эпидемиологического надзора. Автор множества печатных работ на указанную тематику.
"Идея "Азбуки антибиотиков" вынашивалась в течение трех лет как способ донести сложные вещи максимально понятным языком для тех, кто только начинает постигать этот действительно сложный раздел практической медицины, и дать импульс к дальнейшему изучению, не продираясь через дебри терминологии и смежных дисциплин, теряя интерес по дороге."
Нейссерии
В роду нейссерий присутствуют всего два вида патогенных микроорганизмов – N. meningitidis, он же менингококк, и N. gonorrhoeae, он же гонококк. Все остальные нейссерии являются представителями нормальной микрофлоры человека, обитающей на слизистых оболочках верхних дыхательных путей и урогенитального тракта. Кроме того, носительство этих микроорганизмов распространено и среди теплокровных животных.
Neisseria meningitidis
Автор: врач – клинический фармаколог Трубачева Е.С.
Менингококк, без которого мы не смогли бы закрыть тему патогенных нейссерий. Напомним, что в доковидную эру менингококк был одним из немногих микробов, столкновение с которым вело к применению СИЗов и карантина. Микроб очень хорошо изучен и поэтому мы поговорим, чем же он так опасен и почему его надо постоянно держать в голове.
Neisseria spp не патогенна. Что такое баквагиноз
Согласно официальному определению, это невоспалительное заболевание влагалища, характеризующееся резким снижением или полным отсутствием лактофлоры и её заменой на анаэробные бактерии, среди которых наиболее распространены Gardnerella vaginalis (гарднерелла) и Atopobium vaginae (атопобиум).
У здоровых женщин репродуктивного возраста влагалищный микробиом на 95% представлен лактобактериями. Их способность к кислотообразованию (молочная кислота) и продукции перекиси водорода способствует поддержанию кислого pH и подавлению роста остальных микроорганизмов.
Оставшиеся 5% микрофлоры занимают более 300 видов аэробных и анаэробных микроорганизмов, среди которых:
- грамположительные палочки - Corynebacterium spp., Eubacterium spp., Bifidobacterium spp., Propionibacterium spp., Clostridium spp.;
- грамотрицательные палочки (14-55%) - Bacteroides spp., Fusobacterium spp., Prevotella spp., Porphyromonas spp., Leptotrichia spp.;
- грамположительные кокки (30-80%) - Peptostreptococcus spp., Peptococcus spp., Staphylococcus spp., Micrococcus varians, Enterococcus spp., Streptococcus viridans и др.
- грамотрицательные кокки - Veilonella spp., Acidominococcus fermentans, непатогенные Neisseria spp.,
- энтеробактерии - Echerihia coli, Klebsiella spp., Enterobacter spp., Citrobacter spp. и др.
Все это многообразие бактерий является частью нормального «женского» биоценоза, не вызывая симптомов и не требуя лечения. Однако это правомерно до тех пор, пока их численность лактобацилл не начинает снижаться, а остальных - расти.
Neisseria spp лечение. Клиническая эффективность
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
В последние годы левофлоксацин стал более широко использоваться и при других инфекционных заболеваниях. Так, появились сообщения, касающиеся его успешного применения у больных с острыми синуситами. Левофлоксацин в 100% случаев активен против наиболее часто встречающихся бактериальных возбудителей этого заболевания; по эффективности он сопоставим с амоксициллином/клавуланатом в больших дозах и значительно превосходит цефалоспорины, котримоксазол, макролиды и доксициклин.
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.